自免赛道捷报!国产抗IL-17单抗III期临床数据荣登BJD
自身免疫疾病是以局部或全身性异常炎症免疫反应为特征的炎症免疫性疾病,疾病种类多,患者人群庞大,已经成为仅次于肿瘤领域的第二大疾病市场。无论是国内还是国外,自免疾病治疗还有巨大需求尚未被满足。
卫健委统计显示,中国自身免疫性疾病发病人数约8000万人。但是由于用药可及性、疾病认知水平等原因,自免创新药尚未在中国打开局面——2022年全球自免疾病药物市场规模约1317亿美元,而中国自免疾病药物市场规模约36亿美元。
然而,国内IL-17单克隆抗体的市场主要被外资企业所占领,银屑病领域的国产IL-17药物尚未迎来冲线者。
目前,多款自免领域的国产抗体药物已密集进入商业化阶段。IL-17是其中竞争最激烈的靶点之一,已在银屑病、支气管哮喘、慢性阻塞性肺病、类风湿关节炎等疾病中证实其重要作用。
银屑病,俗称“牛皮癣”,是一种免疫介导的、慢性、复发性、炎症性、全身性疾病,由遗传和环境共同诱发,典型临床表现为鳞屑性红斑或斑块。中国有近650万—700万银屑病患者,其中约57%为中度和重度银屑病。银屑病皮损影响外观,不仅给患者的生活、工作和婚姻带来社交障碍与负面心理影响,还会并发关节炎、肥胖、高血压、糖尿病、代谢综合征、重大心血管事件等多种疾病。
近年来,随着银屑病的诊断发展和大众认知提升,加上银屑病发病趋向青壮年、复发率高、用药周期长等特点,使得临床端显示出巨大需求缺口。根据《中国银屑病疾病负担和患者生存质量调研项目研究报告》,国内近62%以上的患者对银屑病治疗结果不满意。其中减少复发已经成为银屑病患者主要诉求之一。
日前,国内首款NDA抗IL-17单抗——赛立奇单抗(GR1501)III期临床试验数据在国际皮肤病学权威期刊British Journal of Dermatology(BJD)上正式发表,为抗IL-17单抗在中、重度斑块状银屑病患者中的优秀疗效再添有力证据。
此次公布的III期数据中,赛立奇单抗显示出对中国中、重度斑块状银屑病患者疗效显著,达到主要终点和次要终点,且耐受性良好。
BJD是英国皮肤病学家协会的官方期刊,旨在发表高质量的皮肤病学领域的最新研究成果。作为皮肤病学领域的权威期刊,BJD在全球都获得广泛认可和推崇(2023年影响因子:10.3分)。根据2023年中国科学院SCI期刊分区,BJD为医学1区、皮肤病学1区期刊。
12周PAS1 75应答率达90.7%,国内首款NDA抗IL-17单抗疗效确切
银屑病皮损面积和严重程度指数(PASI)、银屑病静态临床医生整体评估(PGA)和皮损体表面积(BSA)是医生评估和监测银屑病疾病严重度分级的主要指标。随着银屑病对于患者日常生活影响逐步被重视,评估生活质量的量表工具——皮肤病生活质量指数(DLQI)也被纳入患者病情结果指标。
随着新型生物制剂、小分子靶向药物等新型疗法陆续问世,银屑病的治疗上限也在不断刷新。
最新发布的《中国银屑病诊疗指南》(2023版)中首次具体明确银屑病治疗目的:实现症状和皮损的完全清除或几乎完全清除(PASI100或PASI90)。治疗成功指PASI改善≥75%,或改善50%~75%、DLQI评分≤5分。治疗失败为未达到PASI50或DLQI评分>5分。
2023版指南指出,目前生物制剂在我国正式获批的适应症均为中重度斑块状银屑病,当患者的病情需要接受系统治疗时,特别是接受光疗或传统系统治疗无效、失效或无法耐受且生活质量受到明显影响时,可考虑应用生物制剂。其中明确提出,目前临床已证实生物制剂疗效优于既往传统治疗,建议以皮损完全清除或PASI90、PGA0/1作为达到满意疗效的指标。对比可知,生物制剂的疗效标准直接对标银屑病的最高治疗目的。
此次发表的临床数据显示,GR1501 200mg试验组第12周达到PASI 75的受试者比例为90.7%(安慰剂对照组为8.6%),达到皮损清除/几乎清除(PGA 0/1)的受试者比例为74.4%(安慰剂对照组为3.6%),达到主要临床终点。
试验也达到了次要临床终点:试验组第12周PASI90应答率为74.4%,第52周PASI75应答率96.5%,PASI90应答率为84.1%,PGA0/1应答率为83.7%,保持了高水平的皮损改善,获得持续性的治疗应答。
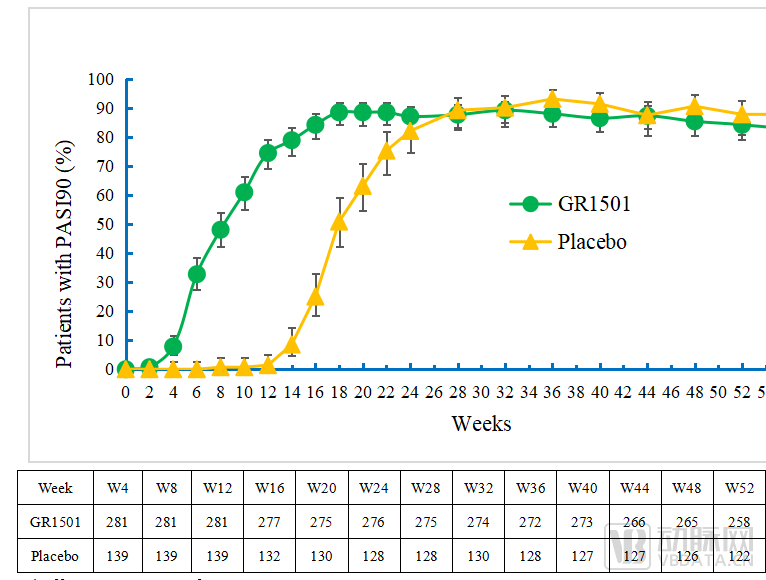
图S1 52周达到PASI90的受试者比例图(±95%CI)
早期起效快,长期控制效果显著,52周复发率仅0.4%
此次试验共入组420例患者,随机分配为试验组(281人)或安慰剂组(139人)——试验组每2周注射一次,共12周,为诱导用药期;后每4周注射一次,直至52周,为维持治疗期。作为对照,安慰剂组患者前12周注射安慰剂,12周至24周诱导用药,每2周一次注射;后每4周一次注射,直至52周。最后一次注射后,对所有患者进行为期12周的安全性随访。疗效通过PGA 0/1和PASI 75/90/100的改善情况进行评估。
●
GR1501的治疗具有起效快的特点。受试者最早在给药后首次访视(第2周)就出现皮损的明显好转(达到PASI 75)。第2周起,试验组PASI评分、PGA评分的降低,相对安慰剂组即出现显著统计学差异,其余指标第4周起也陆续显示出统计学差异。试验组患者在第4周就达到PASI 75、PASI 90和PGA 0/1的比例明显更高。
药物的快速起效在改善银屑病患者的治疗满意度中非常重要。病情更早地得到控制,意味着生活质量能够迅速得到改善,患者满意度进而提升。WHO《银屑病全球报告》显示,94%的银屑病患者期待皮损快速清除,76%的患者期待瘙痒症状减轻。
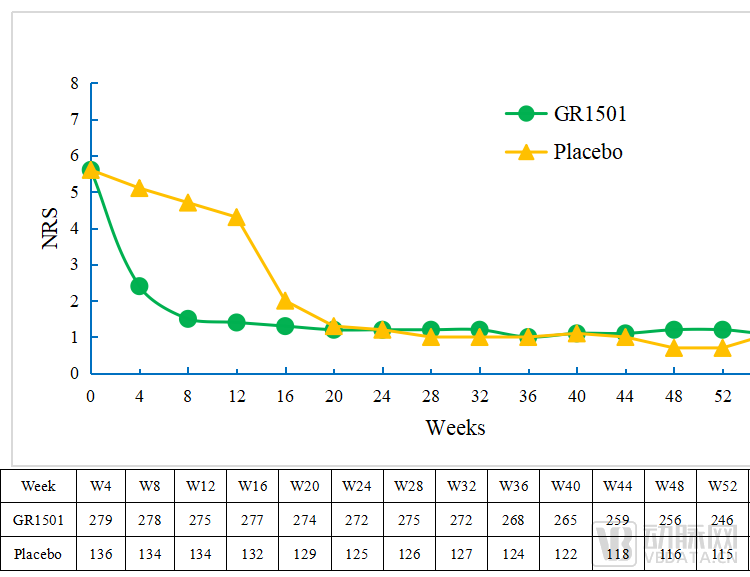
图S5 52周受试者NRS评分比例图
根据瘙痒严重程度NRS评分数据,从给药后首次评价(第4周)开始,试验组的瘙痒症状较安慰剂对照组明显改善,且改善延续至后续维持治疗。给药后8周开始直至60周随访结束,试验组中位瘙痒严重程度NRS评分均保持在1.0分,较基线中位改善超过4分。

图S4 52周受试者DLQI评分比例图
与此类似,根据皮肤病生活质量指数(DLQI)数据统计,从给药后首次评价开始,试验组的生活质量(较基线变化值衡量)就较安慰剂对照组明显改善,且改善延续至后续维持治疗期,给药后12周开始直至60周随访结束,试验组中位DLQI评分均保持在1.0分,较基线中位改善超过10分。
●
2023版指南指出,银屑病是反复发作性疾病,生物制剂的长期维持治疗对于改善生活质量优于间断治疗或按需用药。间断治疗的反复性和长期治疗都将给患者带来较大的经济负担和心理负担。而GR1501在此次临床数据中呈现出优异的维持治疗期疗效改善、低复发率和无反跳的特点。
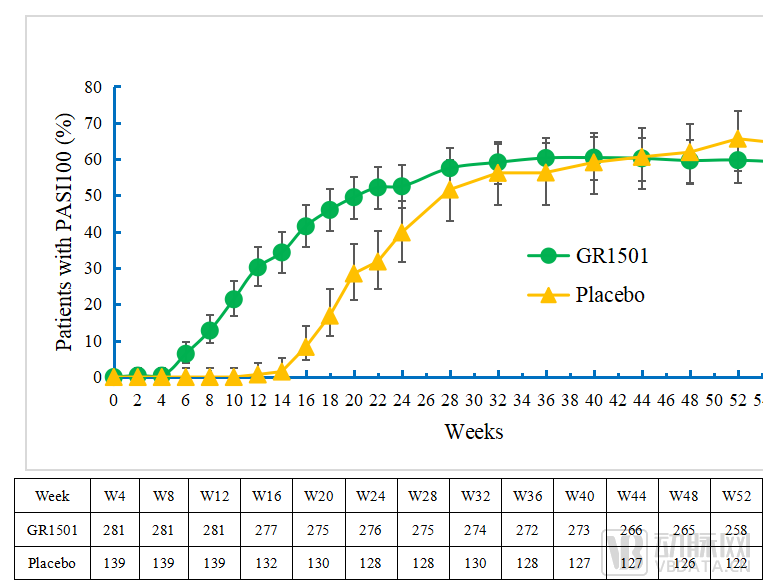
图S252周达到PASI100的患者比例图(±95%CI)
在第52周时,96.5%的受试者达到PASI75、83.7%的受试者达到PGA 0/1,59.7%的受试者达到PASI 100。
以完全缓解(PASI 100)为例,在诱导用药期(0-12周),试验组PASI 100应答率呈现快速爬坡,30.2%的受试者在第12周达到完全缓解。12周后,试验组进入维持治疗期,给药频率从每2周一次下降至每4周一次,但疗效改善一直持续到第52周,PASI 100应答率呈现持续提升。
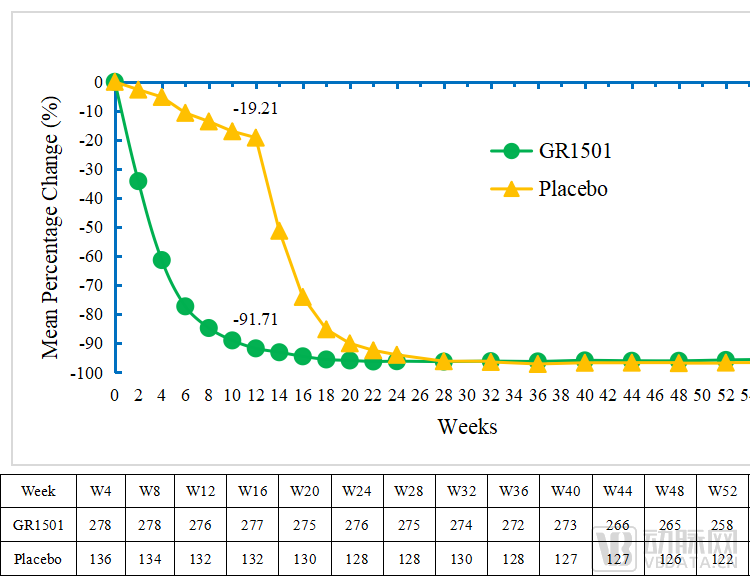
图S3 52周PASI基线平均百分比变化
这意味着,在维持治疗期(即第12周—第52周),赛立奇单抗200mg Q4W维持剂量能够使绝大部分受试者保持高水平的皮损改善,获得持续性的治疗应答。
值得注意的是,试验设置重新分配机制,安慰剂组患者第12周后被重新分配接受GR1501积极治疗,应答率迅速上升。此后,从第24周开始,疗效应答情况与原试验组类似,并持续到第52周。
此外,在PASI 100指标上,赛立奇单抗在第52周和第60周的疗效维持应答显示出潜在优势。在停药随访期(末次给药后12周),受试者仍能维持良好的疾病控制率,展现出良好的疗效维持优势。
●
复发(与基线相比取得的最大改善减少>50%)率低,长期用药期间(52周)试验组复发1例,为0.4%,考虑多为银屑病自然病程导致复发,非停药反应导致复发。停药随访52周后没有出现反跳病例,体现出良好的疾病控制和停药安全性优势。
此外,GR1501重组全人源IgG4型单克隆抗体,免疫原性低,抗药抗体和过敏反应发生风险相对更低;IgG4型介导的ADCC和CDC效应更弱,可降低不良反应的发生风险。
此次临床试验中也显示出良好的安全性和耐受性。试验中未观察到十分常见(≥10%)的不良反应,无乙肝结核再激活。最常报告的药物不良反应(ADR)是上呼吸道感染和注射部位反应,与同靶点药物相似。
国产IL-17单抗上市在即,银屑病市场还有更多想象
2019年3月,诺华IL-17单抗司库奇尤单抗(可善挺®)在国内获批上市,并在2020年降价进入医保,迅速打开国内银屑病生物制剂市场,塑造起较高的品种确定性和认可度。诺华2023年报显示,司库奇尤单抗年度营收达49.8亿美元。去年10月,FDA新批准静脉注射剂型上市,用于治疗成人银屑病关节炎、强直性脊柱炎和非放射学中轴型脊柱关节炎。
近50亿美元的销售峰值背后,是生物制剂渗透率仍处于低值的银屑病药物市场。
据弗若斯特沙利文数据,2021年,中国的银屑病药物市场规模为11亿美元,预计于2030年将增长至95亿美元,复合年增长率为27.1%。其中,生物药2021年市场占有率为29.3%,估计2030年将上升至50.3%,市场前景广阔。
与此同时,国产IL-17药物的竞争也已拉开帷幕。此次发表积极临床数据的智翔金泰赛立奇单抗、恒瑞的夫那奇珠单抗领跑国产赛道,上市申请均已获药监局受理。此外,三生国健、康方生物均已进入III期临床阶段,君实生物、华奥泰生物、创响生物、荃信生物也有管线布局。

智翔金泰在研产品管线图
智翔金泰公告显示,赛立奇单抗的中、重度斑块状银屑病适应症新药上市申请已于2023年3月获得受理;放射学阳性中轴型脊柱关节炎(强直性脊柱关节炎)适应症新药上市申请已于2024年1月获得受理。目前,2项适应症均处于新药上市评审阶段。
伴随国产IL17A单抗迎来上市,银屑病生物制剂市场将迎来新的高潮,也将尚处蓝海的国产自免领域引入新的发展周期。关于IL-17单抗的更多国产化想象,即将到来。